전자 및 방사선 장치
-
-
-
전자 및 방사선 장치
✤ FDA 란?미국에서 의료기기는 "Federal Food, Drug & Cosmetic Act : 연방 식품, 의약품, 화장품법"에 의해 식품, 의약품, 화장품 등과 함께 규제·관리되고 있습니다. 제품에 대한 사전검사 및 승인, 사후검사를 통한 부적합 제품의 제재 그리고 수입품/수출품 검사를 통해 해당 제품의 안전성을 확보합니다.
만약 FDA에서 요구하는 규정을 준수하지 않을 시 미국 내 유통 및 판매가 불가하며 판매 중인 제품이라도 의료기기 규정에 만족되지 않는 제품은 FDA 사후 관리에 의해 시정조치, 리콜, 제품 압류나 폐기 처분, 형사처분 등이 이루어 질 수 있습니다.✤ 관련규정- FD & C Act (Federal Food, Drug & Cosmetic Act : 연방 식품, 의약품, 화장품법)
- 21 CFR (The Code of Federal Regulations : 연방법규집)
✤ 적용 범위- 식품, 화장품, 의약품 및 의료기기(부속품 포함), 동물용 약품, 동물사료, 유아용 유동식, 식품첨가물, 저산성통조림, 산화식품 (단, 육류, 가금류 및 육가공품의 경우 농무부 위생검역국(FSIS, Food Safety & Inspection Service)에서 검사 및 규제 시행
- 방사선기기(전자제품) : 초음파 치료장비, Sunlamp, X-rays, TV수신기등
-
-
-

-
용구 및 방사선 건강평가 (CRDH)란?
- 방사선의 다양하고 잠재적인 위험성에 근거하여 역학적인 실험조사를 하여 안전한 방사선 사용을 권장합니다.
- 방사선을 방출하는 용구와 제품을 평가할 수 있도록 그 측정 방법과 도구를 개발합니다.
- 의료용구의 안전과 효능도에 따라 분류(class I, class II, class III) 하여 판매 전 신고 및 승인을 받도록 합니다.
- 방사선을 방출하는 용구에 대한 실무표준을 개발하여 불필요한 방사선 노출 방지를 위해 사용지침을 마련합니다.
- 의료용구와 방사선 방출 제품에 대한 정확한 정보와 근거를 소비자나 제조업체에 교육을 시행합니다.
-
-
-

-
시장 접근 번호란?
시장 접근 번호는 FDA의 데이터 베이스의 보고서에 대한 유일한 식별 번호입니다. 이 번호는 CDRH 확인 서신에서 제공합니다. 시장 접근 번호는 특정 보고에 대한 의사소통을 촉진시킵니다. 왜냐하면 모든 기관들은 문서가 논의가 되었는지 파악하기 위해 이 시장 접근 번호를 사용할 수 있기 때문입니다. 추가적으로, FDA 수입부서 직원이 제조업자가 최소한으로 수입되는 제품에 대한 요구사항이 기록되었는지 확인하기 위해 시장 접근 번호를 사용합니다.
시장 접근 번호는 보고서가 CDRH의 서류 보관실로 수신된 것을 의미할 뿐 아니라 제조 업체 및 제품에 대한 정보의 일부는 FDA의 데이터베이스에 입력된 것을 의미합니다.
확인 서신은 보고서 제출자가 제공 한 주소로 반환됩니다. 오직 한 부의 복사본만이 배송됩니다. 제출자가 제조업자와 다른 경우, 편지는 보고서 제출자에게만 발송됩니다. 제출자는 제조업자에게 복사본을 보낼 수 있습니다.
제조업자가 제품 보고서, 요약 보고서, 연간 보고서 또는 문의 전 보완 보고서를 보낸 이후, 최소 4주일이 소요됩니다.
제조업체가 전자 보고서 형식으로 제출한 경우, CDRH 데이터베이스의 성공적으로 실리자 마자 전자메일 확인 메시지가 발송됩니다. 일반적으로 전자 보고서는 수신으로부터 1일 안에 데이터베이스에 실립니다.
제조업자는 제품이 미국 상업에 도입되기 이전에 CDRH에 보고서를 제출해야 합니다. 확인 서신과 시장 접근번호는 이러한 보고서가 CDRH에 의해 수신되었다는 증거입니다. 만약 제품이 다른 나라에서 만들어진 후 미국에 수입된 경우, 수입 승인 절차에서는 세관 신고서 FDA 2877양식에 시장 접근번호의 식별을 요구합니다.
-
-
-
-
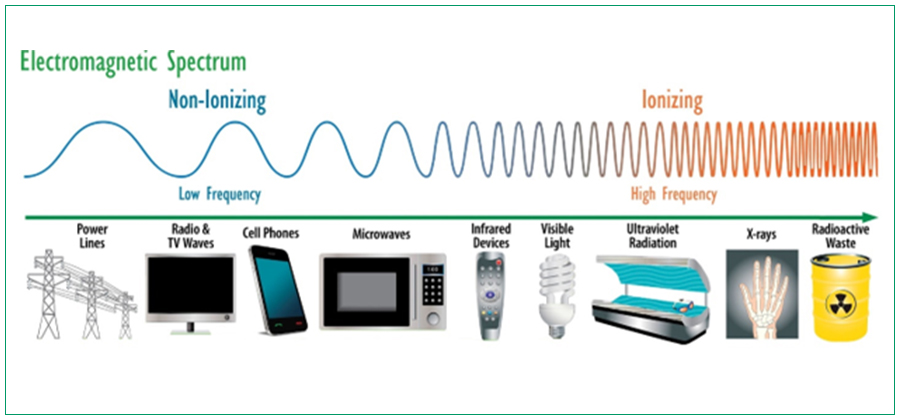
전자제품이란?
전자회로를 포함하고 방사선을 방출하는 모든 제품을 전자 제품이라고 합니다. X방사선(엑스레이), 극 초단파, 전파(고주파(RF)), 레이저, 가시 광선, 음파, 초음파 및 자외선은 전자 제품으로부터 방출되는 다양한 방사선 유형의 몇 가지 예시입니다. 진단용 X선 시스템, 레이저 제품, 레이저 광선 쇼 및 전자 레인지는 방사선을 배출하는 다양한 전자 제품 중 몇 가지 예입니다.
미국(U.S.) 식약청(FDA) 방사선 보건 및 장치 센터는 방사선을 방출하는 전자 제품을 규정하는 것에 대한 책임을 지닙니다. CDRH는 위험하고 불필요한 전자 제품 방사선 노출 로부터 대중을 보호하는 것을 목표로 둡니다. 대부분의 전자 제품의 경우 안정 규제는 CDRH와 주 규제 기관 사이에서 분할됩니다. CDRH는 제품의 제조를 단속하고 주 규제 기관은 제품의 사용을 단속합니다.
연방법 타이틀 21, J 조항, 파트 1000에서 1050(21 CFR 1,000에서 1,050 사이)는 방사선을 방출하는 전자 제품의 제조업자에 대한 안정 규제를 포함합니다. 제조업자는 위험하고 불필요한 방사선을 방출하지 않는 제품을 생산하는 것에 대한 책임을 지닙니다. 모든 제조업자들은 반드시 타이틀 21 CFR 1000, 1002, 1003, 1004 및 1005에서 요구하는 해당 요구사항에 대하여 부합하여야 합니다. 만약 제조업자의 제품에 의무적인 방사선 안전성 수행 규범이 적용되는 경우, 이러한 규범은 21 CFR 1020에서 1050에서 찾을 수 있습니다.
위 FDA 홈페이지에서 언급한 바와 같이, 제조업자가 미국 내에 그들의 제품을 판매하고자 하는 경우, FDA는 제조업자에게 그들의 제품이 요구사항에 부합되는지 요청하고 확인할 것입니다.
-
-
-

-
IGC인증원의 역량
임상시험계획 승인신청(Investigational New Drug application, IND)은 판매용 및 연구용(비판매용) 두 가지 범주가 있으며 다음과 같은 세 가지 신청유형이 있습니다.
1. 연구자 임상시험계획 승인신청해당 신청은 임상시험을 개시하고 수행하는 의사가 제출하며, 의사의 직접적인 지시 하에 시험용 의약품이 투여 또는 조제됩니다. 의사는 미허가 의약품 또는 새로운 적응증이나 새로운 환자군에 대한 허가 의약품에 대한 시험을 제안하기 위해 연구용 임상시험계획 승인신청을 제출할 수 있습니다.
2. 응급상황 사용 임상시험계획 승인신청해당 신청은 미국 식품의약품청이 『연방규정집』312.23조 또는 312.34조에 따른 임상시험계획 승인을 위한 시간이 허용되지 않는 상황에서의 시험약의 사용을 허가할 수 있도록 합니다. 또한 기존의 시험 계획 조건을 충족시키기 못하는 환자를 대상으로 또는 허가된 시험 계획서가 존재하지 않을 경우에 사용될 수 있습니다.
3. 치료목적 임상시험계획 승인신청해당 신청은 임상 시험이 수행되고 미국 식품의약품청의 검토가 진행 중일 때, 임상 시험에서 중증 또는 즉각적으로 생명을 위협할 수 있는 증상에 대한 전망을 보이는 시험약을 위해 제출됩니다. 중증질환의 경우 임상 3상 중이거나 또는 모든 임상시험들이 완료된 의약품을 본 항에 따른 치료용 사용이 가능합니다. 즉각적으로 생명을 위협할 수 있는 질환의 경우, 임상 3상 이전이라 하더라도, 통상 임상 2상 이전이 아니라면 해당 의약품을 본 항에 따른 치료용으로 사용 가능할 수 있습니다.
-
우리가 제공하는 관련 서비스
01시스템 인증
02제품 인증 (유럽 CE 인증, 유라시아 인증)
03제품 시험 (전기 안전, 기계 안전)
04심사자격 인증
05전문인력 양성 교육
