FDA GRAS 신고
페이지 정보

본문
FDA GRAS 신고
 < GRAS(Generally Recognized as Safe)란 >
< GRAS(Generally Recognized as Safe)란 >
GRAS(Generally Recognized as Safe)란
- GRAS란 Generally Recognized as Safe의 약어로 의도한 용도대로 사용했을 경우 일반적으로 안전하다고 여겨지는 성분을 뜻합니다. 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act) Section 201(s) 및 409에 따라 식품에 의도적으로 첨가되는 모든 성분은 식품 첨가물(food additive)이며, 해당 성분이 자격을 갖춘 전문가 사이에서 일반적으로 의도된 사용 조건 하에 안전한 것으로 적절하게 입증되었다고 인식되거나 해당 성분의 사용이 식품 첨가물의 정의에서 달리 제외되지 않는 한, FDA의 시판 전 검토 및 승인을 받아야 합니다.
- GRAS Notice란 해당 성분이 21 CFR 170.30에 따라 의도된 사용 조건 하에 GRAS라는 결론에 근거하여 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act)의 시판 전 승인 요건의 적용을 받지 않는다는 신고자의 견해를 FDA에 통보하는 제출을 의미합니다.
- 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act) Section 201(s)와 409, FDA 시행 규정인 21 CFR 570.3 및 21 CFR 570.30에 따라 식품 첨가물의 사용은 과학적 절차를 통해 또는 1958년 이전에 식품에 사용된 성분의 경우, 식품에서의 일반적인 사용에 기초한 경험을 통해 GRAS가 될 수 있습니다.
- 21 CFR 170.30(b)에 따라 과학적 절차를 통한 일반적인 안전성 인정은 식품 첨가물로서의 성분의 승인을 얻기 위해 요구되는 것과 동일한 양과 품질의 과학적 증거를 요구합니다. 과학적 절차를 통한 안전성 인정은 일반적으로 이용 가능하고 수용된 과학적 데이터, 정보 또는 방법에 기초하며, 이는 일반적으로 출판되는 과학적 데이터, 정보 또는 방법뿐만 아니라 과학적 원리의 적용에 기초하며, 출판되지 않은 과학적 데이터, 정보 또는 방법의 적용에 의해 확증될 수 있습니다. 또한, 21 CFR 170.30(c)와 170.3(f)에 따라 식품에서의 일반적인 사용에 기초한 경험을 통한 안전에 대한 일반적인 인정은 상당 수의 소비자가 식품 사용을 위해 소비한 많은 이력을 요구합니다.
 < GRAS 성분 규제의 역사 (출처: FDA) >
< GRAS 성분 규제의 역사 (출처: FDA) >
GRAS 성분 규제의 역사
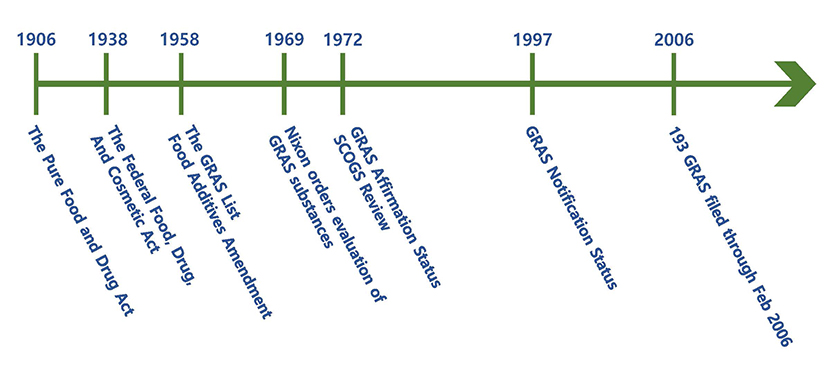
위의 그림은 1906년 순수식품의약품법(Pure Food and Drug Act)의 통과부터 연대표로 나타낸 것입니다.
-
GRAS 제도 시행
- • 1958년, 많은 식품 성분의 안전성은 식품에 사용된 오랜 역사에 의해 확립되었거나 성분의 특성, 사용 조건, 그리고 과학자들이 일반적으로 이용할 수 있는 정보 덕분에, 성분의 안전성을 보장하기 위한 FDA의 공식적인 시판 전 검토를 받을 필요가 없다고 판단하여 식품첨가물 개정법을 제정하였습니다. 이에 따라 기존 식품첨가물 대상에서 GRAS와 특정 성분(ex. color additive)을 면제하였습니다. 1958년 12월 FDA는 21 CFR 182, 184, 186을 제정하고 GRAS 리스트를 포함시켰습니다.
- • 식품 산업에서 GRAS로 간주했던 많은 성분들이 FDA의 GRAS 리스트에서 제외되자 많은 제조업체가 FDA에 편지(opinion letter)를 보내 FDA 관계자가 해당 성분의 GRAS 사용 상태에 대해 비공식 의견을 제공할 의견서를 요청했지만 끝내 1970년에 폐지되었습니다.
-
GRAS 재검토 시작
- • 1969년 10월 30일 FDA가 사이클라민산염을 안전성 문제로 GRAS 리스트에서 삭제하자 당시 대통령이었던 닉슨은 GRAS 성분의 안전성을 심의하도록 명령하였습니다. 1970~1980년대 동안 LSRO(Life Sciences Research Office)는 각 GRAS 성분에 대해 이용 가능한 정보를 검토하고 평가하기 위해 자격을 갖춘 과학자인 SCOGS(Select Committee on GRAS Substances)를 컨설턴트로 선택했습니다. FDA는 SCOGS의 임시 보고서를 대중에게 공개하고 대중이 공청회에서 선정위원회(Select Committee)에 출석할 수 있는 기회를 제공하였습니다. 그리고 최종 보고서 작성 시 청문회에서 제시된 자료, 정보 및 견해를 고려했습니다.
- • SCOGS는 1982년까지 400여종 이상의 성분의 건강 측면에 대한 의견을 FDA에 전달했으며, FDA는 GRAS 추정 성분을 대거 검토하였습니다.
-
GRAS 검토 청원 접수 및 사전승인제 시행
- • 1972년 FDA는 GRAS 사전승인 규정(21 CFR 170.35)를 제정하였습니다. 해당 규정 제정에는 개인이 FDA의 GRAS 검토의 일부로 간주되지 않는 GRAS 상태를 검토하도록 FDA에 청원할 수 있는 메커니즘(the GRAS affirmation petition process)이 포함되었습니다.
-
GRAS 신고제 실시
- • 1997년 4월 FDA는 특정 성분의 사용이 GRAS라는 결정을 FDA에 신고할 수 있는 신고 절차를 확립할 것을 제안했습니다. 이에 따라 규제 절차 완화를 위해 GRAS 사전승인제도를 GRAS 신고제도로 변경하고, 업체가 제출한 자료를 평가하는 방식으로 전환하는 규정안을 발표하였습니다.
 < GRAS 신고 프로그램 절차 >
< GRAS 신고 프로그램 절차 >
GRAS 신고 프로그램 절차
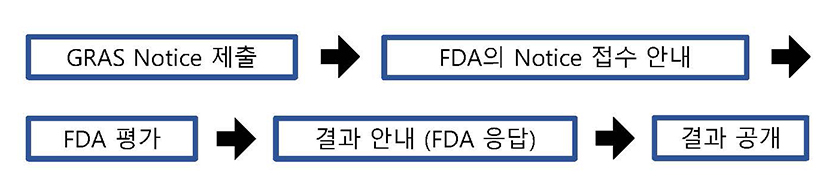
- GRAS 신고 프로그램(GRAS notification program)은 성분의 사용이 GRAS임을 확인하도록 FDA에 청원하는 대신 개인이 해당 성분의 사용이 GRAS라는 결정을 FDA에 알릴 수 있는 자발적인 메커니즘을 제공합니다.
-
FDA는 개인이 기관에 신고하기 전에 GRAS 신고 제출 절차를 철저히 검토할 것을 권장합니다. 또한, 신고자는 신고자의 GRAS 신고서 제출과 관련될 수 있는 문제를 논의하기 위해 FDA와 제출 전 회의를 요청할 수 있습니다.
- • GRAS 신고를 제출할 때 평가를 위해 엑세스할 수 있는 전자 형식이나 종이로 제출할 수 있습니다. GRAS 신고서를 종이로 보내는 경우 종이 사본 한 장이면 충분합니다.
-
일반적인 절차로는 신고자가 FDA 3667 양식을 작성하여 관련 근거 자료를 취합하여 함께 FDA 제출합니다. FDA는 신고를 받은 후 30일 이내에 신고 받은 날짜를 서면으로 신고자에게 알립니다. 그 후 FDA는 제출된 신고가 GRAS 결정을 위한 충분한 근거를 제공하는지 여부와 신고에 포함된 정보 또는 FDA가 사용할 수 있는 정보가 해당 성분의 사용이 GRAS인지 여부에 대한 의문을 제기하는 문제를 발생하는지 여부를 평가합니다. 때때로 FDA는 다른 기관과 협의하기도 합니다. 예를 들어 신고서에 육류 및 가금류 제품 사용이 포함된 경우, FDA 미국 농무부의 식품 안전 검사국(Food Safety and Inspection Service of the U.S. Department of Agriculture)과 협의할 수 있습니다. 위의 평가에 따라 FDA는 세 가지 유형의 편지 중 하나로 신고자에게 회신합니다.
- ① 첫 번째 유형의 편지에는 FDA가 신고자의 GRAS 결정 근거에 대해 의문을 제기하지 않는다고 명시되어 있습니다. 이는 무엇보다도 라벨링과 관련된 잠재적인 문제, 특정 식품에서의 성분의 사용 및 색소 첨가물에 대한 요구사항을 언급할 수 있습니다.
- ② 두 번째 유형의 편지에는 FDA는 신고가 GRAS 결정을 위한 충분한 근거를 제공하지 않는다고 결론을 내립니다 (예: 신고서에 적절한 데이터 및 정보가 포함되어 있지 않거나 사용 가능한 데이터 및 정보가 신고된 성분의 안전성에 대한 의문을 제기하기 때문).
- ③ 세 번째 유형의 편지에는 해당 기관이 신고자의 요청에 따라 GRAS 신고 평가를 중단했다고 명시되어 있습니다.
* FDA는 'Summary of All GRAS Notices'이라는 웹 페이지에 GRAS Notification 결과를 업데이트합니다.
https://www.cfsanappsexternal.fda.gov/scripts/fdcc/?set=GRASNotices
 < GRAS 신고 시 필요 서류 >
< GRAS 신고 시 필요 서류 >
GRAS 신고 시 필요 서류
GRAS 신고 시 FDA 3667 양식을 작성하여 제출하여야 하며, 해당 양식 내 필요한 정보는 다음과 같습니다.
-
• 제출물에 대한 소개 정보
: 신규 제출인지 또는 이전에 제출했던 GRAS 신고에 대한 수정 또는 보완인지에 대한 여부, 전자 전송으로 제공된 모든 파일에 컴퓨터 바이러스가 없다고 판단했는지 여부 등 - • 신고자에 대한 정보 (신고자를 대신하는 변호사 또는 대리인)
- • 일반 행정 정보
- • 사용 목적
- • 성분 식별 정보
- • 제조방법
- • 사양
- • 식이노출
- • 자체 제한 사용 수준
- • (해당 시) 1958년 이전에 식품에 일반적으로 사용됨
- • GRAS 결정의 근거에 대한 종합적인 논의
- • 문헌
- • 서명
- 이전글ISO/SAE 21434:2021 – 차량용 사이버보안 엔지니어링 23.11.24
- 다음글ISO 37301:2021 준법경영시스템 23.10.16
댓글목록
등록된 댓글이 없습니다.

